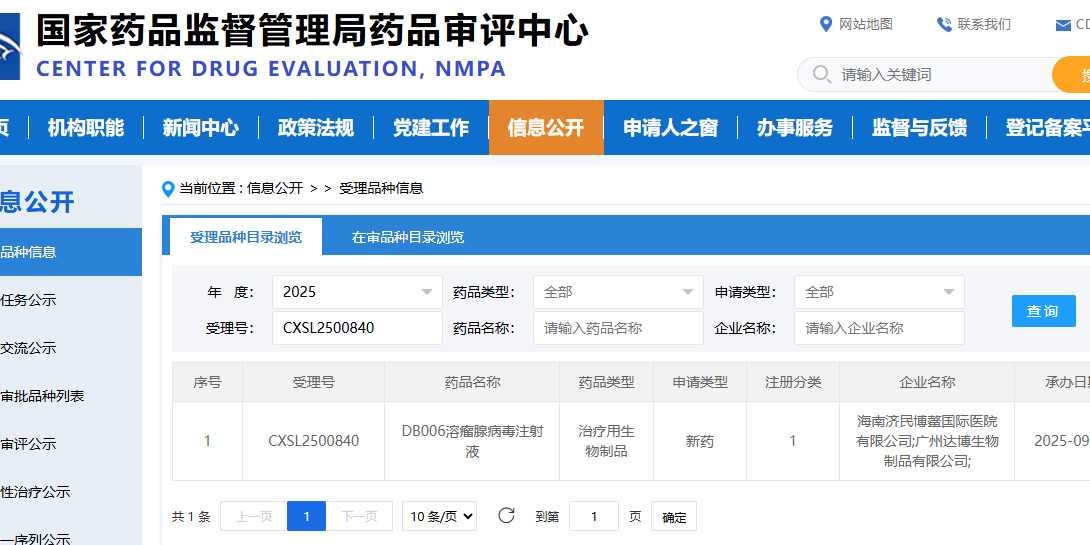
近日,海南济民博鳌国际医院有限公司首款创新药产品DB006溶瘤腺病毒注射液在晚期恶性实体肿瘤中安全性与有效性的I期临床研究申请,已正式获得国家药品监督管理局药品审评中心受理(受理号:CXSL2500840)。这一进展,标志着海南济民博鳌国际医院有限公司在肿瘤免疫治疗创新领域迈出了坚实一步。DB006溶瘤腺病毒注射液是第一款来自博鳌乐城国际医疗旅游先行区的创新药,标志着博鳌乐城先行区在创新药物研发与应用方面取得了重要进展。
关于E10K
据公开数据显示,2020年中国新增癌症病例457万,癌症死亡人数300万。中国癌症防治工作面临持续挑战,各类癌症的防止需求亟待满足。在此背景下,创新治疗方法的探索具有积极意义。
溶瘤病毒疗法作为抗肿瘤治疗的研究方向之一,通过基因工程改造,旨在实现选择性复制并作用于肿瘤细胞。该技术路线为肿瘤治疗提供了新的研究思路。
DB006溶瘤腺病毒注射液(代号E10K-1A)项目的专利及技术受让自广州达博生物制品有限公司,由广州达博生物制品有限公司研发及生产,用于治疗晚期恶性实体肿瘤的生物制品。本制品利用基因工程的方法,对溶瘤病毒进行了多个方面的改造,以期实现选择性感染肿瘤细胞、增强病毒的肿瘤特异性复制能力;另外,本制品通过多个抗肿瘤及免疫调节基因的导入,探索利用多个靶点对抗肿瘤的途径。临床前研究显示,该产品在部分肿瘤模型中展现出研究价值,其作用机制也为肿瘤免疫治疗研究提供了参考。
里程碑意义
博鳌国际医院多靶点溶瘤腺病毒获CDE受理,是一个具有里程碑意义的信号。随着多靶点溶瘤病毒这一药物管线的增加,有望丰富医院肿瘤免疫治疗领域产品管线,还能结合达博生物的基因药物与博鳌国际医院在研的DC肿瘤疫苗,探索肿瘤从预防到治疗的全流程管理方案,致力于构建“基因-免疫”多靶点治疗模式,旨在为患者提供新的治疗选择。
乘着海南政策创新的春风,随着《海南自由贸易港博鳌乐城国际医疗旅游先行区生物医学新技术促进规定》的落地,乐城在监管上的创新实践(如生物医学新技术转化应用、附条件批准、基于RWD的审评)将为全国监管体系的改革提供宝贵经验。未来,“试点-总结-推广”将成为常态,整个国家的审评体系将更具弹性和适应性。
博鳌乐城先行区转化应用政策优势
2024年11月29日,海南省七届人大常委会第十四次会议审议通过了《海南自由贸易港博鳌乐城国际医 疗旅游先行区生物医学新技术促进规定》(以下简称《规定》),自2025年2月1日起施行。《规定》明确创新生物医学新技术转化应用实施路径,规定转化应用审批程序和条件要求。加强真实世界数据应用,支持先行区医疗机构在生物医学新技术转化应用过程中真实世界数据的有效积累,提升真实世界数据的适用性,为国外已上市的产品在国内申请上市提供数据参考。先行区医疗药品监督管理机构应当结合技术评估结果,自受理申请之日起六十日内作出转化应用审查决定,符合规定的,予以批准转化应用。先行区医疗机构在获准生物医学新技术转化应用后,应当向省人民政府医疗保障、卫生健康主管部门申请价格备案。
随后,博鳌乐城国际医疗旅游先行区出台《海南博鳌乐城国际医疗旅游先行区生物医学新技术转化应用项目技术评估暂行办法》(以下简称《办法》)和《海南博鳌乐城国际医疗旅游先行区生物医学新技术转化应用申报指南(暂行)》。《办法》规定:生物医学新技术转化应用的,应由具备条件的先行区医疗机构向先行区医疗药品监督管理机构提出申请。